- Sutrumpinimai:
- ASH – amiodarono sukelta hipotirozė
- AST – amiodarono sukelta tirotoksikozė
- ATPO – autoantikūnai prieš skydliaukės peroksidazę
- D1 – I tipo 5-dejodinazė
- D2 – II tipo 5-dejodinazė
- DEA – dezetilamiodaronas
- T3 – trijodtironinas
- T4 – tiroksinas
- TTH – tirotropinis hormonas
Amiodaronas – tai stiprus III klasės antiaritminis vaistas, dažniausiai skiriamas skilvelinių ar supraventrikulinių aritmijų gydymui. Šis vaistas sukelia nemažai šalutinių reiškinių, dažnai apribojančių jo vartojimą: amiodaronas gali pažeisti skydliaukę, kepenis, odą, plaučius, rageną, bei kitus gyvybiškai svarbius organus. Amiodaronas, savo sudėtyje turėdamas didelį jodo kiekį, gali sukelti skydliaukės hormonų koncentracijų kraujyje pokyčius bei visą spektrą skydliaukės disfunkcijos: nuo subklinikinės arba klinikinės hipotirozės iki sunkios tirotoksikozės. Mokslinių tyrimų duomenys rodo, kad apie 15-20 proc. pacientų, ilgą laiką vartojančių amiodaroną, pasireiškia skydliaukės disfunkcija.
- Amiodarono struktūra ir farmakokinetika
Amiodaronas priklauso benzofurano dariniams. Savo struktūra jis labai panašus į skydliaukės hormonus trijodtironiną (T3) ir tetrajodtironiną/tiroksiną (T4). Kiekviena amiodarono molekulė savo sudėtyje turi po 2 jodo atomus, sudarančius apie 37% jos masės. Taigi, vartojant standartines amiodarono dozes (100–600 mg per dieną), pacientai gauna 3–21 mg jodo per dieną, o tai yra 35–140 kartų daugiau nei rekomenduojama dienos norma (150 μg per dieną).
Dėl sudėtyje esančio benzeno žiedo amiodaronas yra labai tirpus lipiduose. Didelis lipofiliškumas sąlygoja tai, kad didelė vaisto koncentracija susidaro daugelyje audinių ir organų, ypač plaučiuose, kepenyse, odoje, riebaliniame audinyje, raumenyse ir skydliaukėje. Daugiausiai amiodarono metabolizuojama kepenyse dealkilinimo būdu, susidarant pagrindiniam metabolitui dezetilamiodaronui (DEA). Ši medžiaga yra farmakologiškai aktyvi, o jos farmakologinės ir toksikologinės savybės panašios į amiodarono. Vidutinis amiodarono eliminacijos pusperiodis yra 40 dienų, o jo metabolito DEA – 57 dienos, todėl nutraukus vaisto vartojimą jo poveikis, o taip pat ir sukelti nepageidaujami reiškiniai, gali išlikti 6 mėn. ir ilgiau.
- Fiziologinis amiodarono poveikis skydliaukės hormonų apykaitai
Vykstant amiodarono metabolizmui kepenyse, į kraują patenka didelis laisvo jodo kiekis. Jodo koncentracija kraujyje tampa 20-40 kartų didesnė nei įprastinėmis sąlygomis. Šis perteklius slopina skydliaukės hormonų sintezę bei sekreciją. Laikinas jodo organifikacijos sutrikimas, vadinamas Wolff-Chaikoff efektu – tai fiziologinis skydliaukės autoreguliacinis mechanizmas, apsaugantis nuo hipertirozės išsivystymo esant jodo pertekliui. Dėl Wolff-Chaikoff efekto, net ir esant sveikai skydliaukei, pradėjus vartoti amiodaroną padidėja tirotropinio hormono (TTH) kiekis kraujyje.
Be to, amiodaronas sutrikdo dejodinazių aktyvumą. Amiodaronas inhibuoja II tipo 5-dejodinazę (D2) hipofizėje. Todėl pirmuosius mėnesius vartojant amiodaroną stebimas TTH koncentracijos padidėjimas (iki 20 mU/l), tačiau šis padidėjimas nėra sąlygotas hipotirozės, taigi pakaitinis gydymas levotiroksinu nereikalingas.
Periferiniuose audiniuose, ypač kepenyse, šis vaistas inhibuoja ir I tipo 5-dejodinazę (D1), verčiančią T4 į daug aktyvesnį T3. Dėl D1 slopinimo vartojant amiodaroną mažėja periferinė T4 konversija į T3, ir galiausiai sumažėja T3 koncentracija bei padidėja T4 bei reversinio T3 koncentracija. Minėto fermento slopinimas gali tęstis keletą mėnesių po amiodarono nutraukimo. Pirmomis gydymo amiodaronu savaitėmis T3 koncentracija gali sumažėti, o T4 koncentracija gali padidėti daugiau nei 30% buvusio prieš gydymą lygio. Vėliau T3 koncentracija normalizuojasi, tačiau dažniausiai vis tiek lieka arba nedaug sumažėjusi, arba ties apatine normos riba (1 lentelė)
Amiodaronas taip pat slopina skydliaukės hormonų patekimą į periferinius audinius. Dėl to, vartojant amiodaroną 1 – 4 mėnesius, serumo T4 kiekis gali padidėti apie 40% buvusio prieš gydymą šiuo vaistu lygio, tačiau šis T4 koncentracijos padidėjimas nesukelia hipertirozės.
Jei amiodaronas vartojamas ilgiau kaip 3 mėnesius, TTH kiekis normalizuojasi, o laisvas ir bendras T4 bei rT3 gali likti truputį padidėję (1 lentelė).
| Hormonai | Ūmūs poveikiai (< 3 mėn.)hormonų koncentracijai kraujyje | Lėtiniai poveikiai (>3 mėn.) hormonų koncentracijai kraujyje |
| Laisvas T4 | ↑ 50% | ↑ 20 – 40% arba ties viršutine normos riba |
| Laisvas T3 | ↓ 15-20% | Lieka ties žemutine normos riba |
| TTH | ↑ 20-50% (<20 mU/l) | Normos ribose |
- Skydliaukės disfunkcijos vartojant amiodaroną patogenezė
Amiodarono poveikis skydliaukei gali būti skirstomas į vaisto molekulės poveikį bei iš vaisto atsipalaidavusio jodo pertekliaus poveikį. Jų sukeliamas pasekmes toliau galima suskirstyti į skydliaukės hormonų sintezės sutrikimus bei skydliaukės ląstelių tiesioginį pažeidimą.
Amiodaronas ir jo aktyvus metabolitas DEA pasižymi tiesioginiu citotoksiniu poveikiu skydliaukės folikulinėms ląstelėms, todėl gali sukelti destrukcinį tiroiditą.
Su amiodaronu pasisavinamas didelis jodo kiekis, kuris, esant predisponuojančiai skydliaukės patologijai (pvz. Greivso ligai, autonominiams mazgams skydliaukėje ar lėtiniam autoimuniniam tiroiditui), gali sukelti hipertirozę arba hipotirozę.
- AMIODARONO SUKELTA HIPOTIROZĖ
Epidemiologija
Regionuose, kur jodo suvartojama pakankamai, amiodaronas hipotirozę sukelia dažniau nei hipertirozę. Įvairių tyrimų duomenimis, subklinikinė arba klinikinė hipotirozė pasireiškia iki 26 proc. pacientų, vartojančių amiodaroną (JAV ir Didžiojoje Britanijoje – apie 13 proc., Italijoje ir Ispanijoje – mažiau 6 proc.) Amiodarono sukeltą hipotirozę (ASH) predisponuoja moteriška lytis (moterų/vyrų santykis 1,5:1), vyresnis amžius, lėtinis autoimuninis tiroiditas arba prieš vaisto vartojimą nustatyta padidėjusi autoantikūnų prieš skydliaukės peroksidazę (ATPO) koncentracija. Tikimybė moterims, kurioms iki gydymo amiodaronu randami šie autoantikūnai, susirgti ASH yra 13,5 karto didesnė nei vyrams su nepadidėjusia ATPO koncentracija. 68% pacientų su ASH prieš tai buvo diagnozuota skydliaukės patologija.
Dažniausiai ASH prasideda per pirmuosius amiodarono vartojimo metus. Priklausomybės tarp amiodarono dozės ir ASH išsivystymo dažnio iki šiol nenustatyta. Nenustatyta ir patikimo skirtumo tarp ASH dažnio vartojant generinius ir etinius amiodarono preparatus. Naujesnis preparatas dronedaronas savo sudėtyje neturi jodo, todėl šis vaistas sukelia mažiau šalutinių reiškinių, tačiau pažymi ne tokiu geru antiaritminiu poveikiu kaip amiodaronas.
Patogenezė
Pradėjus vartoti amiodaroną ir esant predisponuojančiai skydliaukės patologijai jodo pertekliaus sąlygotas Wolff-Chaikoff efektas užsitęsia ir sąlygoja ASH išsivystymą. Manoma, kad pacientams su lėtiniu autoimuniniu tiroiditu ASH taip pat vystosi ir dėl amiodarono sukelto nespecifinio skydliaukės folikulų pažeidimo – tai paspartina tiroidito eigą ir hipotirozės pasireiškimą.
Klinikiniai simptomai
Klinikiniai simptomai panašūs į lengvos pirminės hipotirozės požymius. Pacientai skundžiasi nuovargiu, bendru silpnumu, susilpnėjusiu protiniu darbingumu, šalčio netoleravimu, sausa oda, obstipacijomis, kūno masės augimu. Jei hipotirozė sunki, gali prasidėti ventrikulinė tachikardija (torsades de pointes) ir miksedema.
Diagnostika
Vartojant amiodaroną, skydliaukės veikla turėtų būti tiriama prieš vaisto paskyrimą, 3-4 terapijos mėnesį, o vėliau periodiškai monitoruojama visą gydymo laikotarpį ir metai po amiodarono nutraukimo. TTH koncentracijos padidėjimas po kelių savaičių nuo amiodarono paskyrimo yra svarbus prognostinis rodiklis, kad gali prasidėti ASH. Gydymo amiodaronu pradžioje hipotirozė diagnozuojama nustačius padidėjusią TTH (dažniausiai >20 mU/l) bei sumažėjusią laisvo T4 koncentraciją kraujo serume. Jei pradėjus vartoti amiodaroną TTH koncentracija kraujyje yra <20 mU/l, rekomenduojama tyrimą kartoti po 6-8 savaičių. Išlikus padidėjusiai TTH konc. (dažniausiai <10 mU/l), tačiau esant normaliai laisvo T4 konc. nustatoma subklinikinė ASH. Jei TTH konc. lieka padidėjusi (>10 mU/l) ir nustatoma sumažėjusi laisvo T4 konc. – nustatoma klinikinė ASH.
Gydymas
Pacientus, kuriems įtariama ASH, rekomenduojama siųsti endokrinologo konsultacijai. Išsivysčius ASH amiodarono nutraukti nebūtina, jei šis vaistas padeda išvengti pavojingų aritmijų.
Kadangi levotiroksinas gali skatinti širdies aritmijų pasireiškimą, subklinikinės ASH gydyti levotiroksinu dažniausiai nereikia, ypač jeigu pacientas yra vyresnio amžiaus. Tokiems pacientams rekomenduojama kartoti skydliaukės hormonų tyrimus po 4-6 mėn.
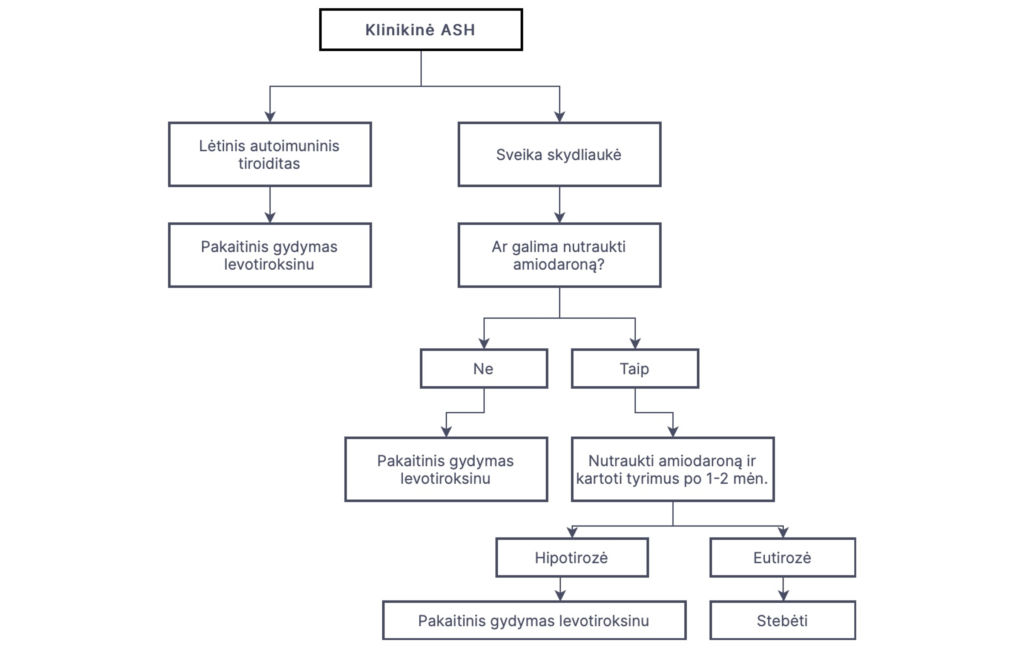
Jeigu išsivystė klinikinė ASH, pacientams be nustatytos skydliaukės patologijos rekomenduojama, jei galima, nutraukti amiodaroną ir laukti 1-2 mėn, kol normali skydliaukės veikla atsistatys. Jei šis antiaritminis vaistas pacientui būtinas, išsivysčius klinikinei ASH rekomenduojama skirti pakaitinę terapiją levotiroksinu (1 paveikslas).
Pacientams, kuriems skydliaukės liga diagnozuota jau anksčiau, terapija amiodaronu gali būti tęsiama, papildomai skiriant levotiroksino. Jei pacientas vartojo levotiroksiną iki amiodarono paskyrimo, atsižvelgiant į skydliaukės funkciją, padidinama levotiroksino dozė.
Pirmojo pasirinkimo vaistas gydyti ASH – levotiroksinas. Pradedama nuo mažų dozių (25-50 μg/d), jos koreguojamos kas 4-6 savaitės. Atsižvelgiant į tai, kad daugelis pacientų, vartojančių amiodaroną, serga širdies ligomis ir aritmijomis, rekomenduojama TTH koncentraciją palaikyti viršutinėje normos pusėje arba šiek tiek virš viršutinės normos ribos (bet <10 mU/l), o laisvo T4 konc. turi būti normos ribose.
Nutraukus amiodaroną rekomenduojama svarstyti levotiroksino dozės mažinimą arba gydymo nutraukimą, nes galima spontaninė ASH remisija. Kelių tyrimų metu nustatyta, kad spontaninė ASH remisija po amiodarono nutraukimo įvyko daugumai pacientų, kuriems anksčiau nebuvo nustatyta skydliaukės patologija, tačiau spontaninis pasveikimas įvyko tik 50% asmenų su predisponuojančia skydliaukės patologija. Jei amiodarono terapija tęsiama, ASH gali pereiti į destrukcinę amiodarono sukeltą tirotoksikozę (2 tipo AST).
- AMIODARONO SUKELTA TIROTOKSIKOZĖ
Epidemiologija
Amiodarono sukelta tirotoksikozė (AST), ypač 1 tipo, dažnesnė jodo trūkumo vietovėse. Tai yra aktualu ir mums, nes Lietuva priskiriama vidutinio jodo trūkumo regionui. AST dažniau nustatoma vyrams (paplitimas tarp vyriškos ir moteriškos lyties yra 3:1), pasireiškimo dažnis tarp vartojančių amiodaroną – 2-10%. 2 tipo AST dažnesnė regionuose, kur jodo suvartojama pakankamai, o išsivystymo rizika tiesiogiai proporcinga kumuliacinei amiodarono dozei.
Etiologija, patogenezė
Jodo perteklius, gaunamas su amiodaronu, gali sukelti Jod-Basedow efektą, kuris pasireiškia hipertiroze dėl skydliaukės hormonų gamybos ir sekrecijos suaktyvėjimo esant jodo pertekliui. Šis efektas pasitaiko jodo trūkumo vietovėse (prie jodo trūkumo prisitaikiusi, hiperplazavusi skydliaukė gauna daugiau jodo, joje suaktyvėja T4 ir T3 sintezė ir vystosi 1 tipo AST), taip pat turintiems autoimuninių ar mazginių skydliaukės pakitimų. Jodo perteklius taip pat gali sukelti tiesioginį toksinį poveikį skydliaukės ląstelėms ir skydliaukės destrukcijos sąlygotą tirotoksikozę dėl padidėjusio skydliaukės hormonų patekimo į kraują – taip vystosi 2 tipo AST. Be to, pati amiodarono molekulė gali sukelti tiesioginį skydliaukės ląstelių pažeidimą ir destrukcinį tiroiditą. 2 tipo AST gali atsirasti bet kuriuo gydymo amiodaronu metu bei 6-9 mėn. po gydymo dėl ilgo vaisto skilimo pusperiodžio ir susidariusio jodo pertekliaus.
Klinikiniai simptomai
AST pirminis pasireiškimas dažnai susijęs su gydomos širdies ligos simptomų sustiprėjimu ar atsinaujinimu. Tai gali būti padidėjęs skilvelinių ar supraventrikulinių aritmijų dažnis ir stiprumas, atsinaujinusios ar padažnėjusios širdyje implantuoto kardioverterio-defibriliatoriaus iškrovos. Yra pastebėta, kad sergantiems prieširdžių virpėjimu ir vartojantiems varfariną išsivysčius AST gali padidėti INR indeksas, nes hipertirozė pagreitina krešėjimo faktorių degradaciją, tokiu būdu santykinai „sustiprėja“ varfarino poveikis nekeičiant dozės. Todėl, esant nepaaiškinamam INR padidėjimui vartojantiems amiodaroną, reikėtų įtarti AST. AST taip pat gali pasireikšti gūžio ar oftalmopatijos požymiais, ypač jei pacientas iki amiodarono vartojimo sirgo Greivso liga.
AST klasifikacija ir diagnostika
AST paprastai diagnozuojama, kai kraujo serume randama sumažėjusi TTH bei padidėjusios bendro ar laisvo T3 koncentracija. Serumo T4 koncentracijos nustatymas nėra toks patikimas, nes amiodarono terapijos pradžioje dėl sumažėjusios T4 konversijos į T3 neretai būna padidėjusi T4 koncentracija net ir nesant hipertirozės. Patogenetiškai AST skiriama į du tipus. 1 tipo AST išsivysto dėl Jod-Basedow efekto, esant predisponuojančiai skydliaukės patologijai. Kaip minėta, ji dažnesnė jodo trūkumo regionuose ir asmenims, turintiems besimptomę ar kliniškai pasireiškusią skydliaukės patologiją (pvz., difuzinį ar mazginį gūžį ir Greivso ligą), kurios pasekoje jodo pertekliaus fone atsiranda nekontroliuojama skydliaukės hormonų sintezė ir sekrecija. Šiam AST tipui būdinga padidėjusios autoantikūnų (prieš tiroglobuliną, ATPO bei antikūnų prieš TTH receptorius) koncentracijos, o skydliaukės scintigrafijoje radionuklido kaupimas skydliaukėje paprastai būna normalus arba padidėjęs. Be to, esant 1 tipo AST, skydliaukės ultragarsinio tyrimo metu matoma normali arba suintensyvėjusi kraujotaka.
2 tipo AST atsiranda dėl amiodarono sukelto skydliaukės destrukcinio tiroidito iki tol sveikoje skydliaukėje. Uždegimą sukelia jodo pertekliaus ir paties amiodarono tiesioginis toksinis poveikis folikulinio epitelio ląstelėms. Šio AST tipo atveju būna ženkliai padidėjusi interleukino-6 koncentracija kraujyje, o histologiškai stebimas folikulų pažeidimas, fibrozė, epitelio atrofija ir limfocitų infiltracija. 2 tipo AST atveju radionuklido sukaupimas skydliaukėje būna sumažėjęs (dažniausiai nesiekia 1%), o ultragarsinio tyrimo metu stebima vangi skydliaukės kraujotaka. Vis dėlto neretai abu AST tipai pasireiškia kartu ir tai apsunkina AST diferencinę diagnostiką bei gydymą. 2 lentelėje pateikiami AST tipų skirtumai.
| 1 tipo AST | 2 tipo AST | |
| Atsiranda esant skydliaukės patologijai | Taip | Ne |
| Patogenetinis mechanizmas | Perteklinė skydliaukės hormonų gamyba esant jodo pertekliui | Perteklinis skydliaukės hormonų išskyrimas dėl destrukcinio tiroidito |
| Pradžia | Anksti – vidutiniškai 3 mėn. nuo amiodarono vartojimo pradžios | Vėlai – vidutiniškai 30 mėn. nuo amiodarono vartojimo pradžios |
| Gūžys | Dažniausiai difuzinis ar mazginis | Retais atvejais nedidelis difuzinis |
| Radioaktyvaus jodo kaupimas skydliaukėje | Mažas, normalus ar padidėjęs | Mažas |
| Spontaninė remisija | Mažai tikėtina | Labiau tikėtina |
| Gydymas | Tionamidai | Gliukokortikoidai |
| Vėliau atsirandantis hipotirozė | Nebūdinga | Galima |
Profilaktika
Profilaktinis skydliaukės veiklos tikrinimas vartojant amiodaroną būtinas, nes esant AST klasikinių hipertirozės simptomų gali ir nebūti. Taip yra dėl to, kad vartojant amiodaroną sumažėja T4 konversija į aktyvųjį T3, be to, pats amiodaronas pasižymi antiadrenerginiu veikimu, dėl kurio maskuojamas skydliaukės hormonų pertekliaus klinikinis pasireiškimas. Pagrindinis profilaktinės patikros metodas – TTH bei tironinų (T3 ir T4) koncentracijos kraujyje nustatymas. Kartu su hormonų tyrimais rekomenduojama atlikti skydliaukės antikūnų tyrimus bei ultragarsinį skydliaukės tyrimą, jei pacientui anksčiau buvo diagnozuota skydliaukės patologija, yra teigiama skydliaukės ligų šeiminė anamnezė, arba jei čiuopiami skydliaukės pakitimai. Laiku diagnozuoti ir pradėti AST gydymą yra labai svarbu, nes AST yra susijusi su padidėjusia miokardo infarkto, insulto bei skilvelinių aritmijų rizika. Įtarus AST būtina siųsti pacientą endokrinologo konsultacijai – AST tipo patikslinimui ir tinkamo gydymo parinkimui.
Gydymas
Diagnozavus AST pirmiausia reikia nuspręsti, ar galima tęsti gydymą amiodaronu, ar šį vaistą reikia nutraukti. Aiškaus ir vienareikšmio ekspertų sutarimo šiuo klausimu nėra. Sprendimas tęsti amiodarono skyrimą arba šį vaistą nutraukti turi būti priimtas atsižvelgus į širdies ligą, alternatyvių širdies aritmijų gydymo būdų prieinamumą bei AST tipą. Jeigu kartojasi gyvybei pavojingos aritmijos arba pacientas yra sunkios būklės, rekomenduojama tęsti gydymą amiodaronu. Vienok tęsiant amiodarono skyrimą, išliekantis padidėjęs jodo kiekis kraujyje sumažina tionamidų efektyvumą ir eutirozės atstatymo galimybes esant 1 tipo AST. Svarbu paminėti tai, kad amiodaronas pasižymi β-adrenoreceptorius blokuojančiu poveikiu bei slopina tironinų konversiją iš T4 į T3 bei slopina T3 jungimąsi prie skydliaukės hormonų receptorių, todėl amiodarono terapijos nutraukimas išsivysčius AST gali ne pagerinti, bet pabloginti tirotoksikozės poveikį širdžiai.
Esant 2 tipo AST amiodaroną tęsti galima, tačiau reikia prisiminti, jog tirotoksikozės periodas gali užtrukti, taip pat AST gali kartotis. Nutraukus gydymą amiodaronu, apie 20% 2 tipo AST atvejų praeina savaime po 3-5 mėnesių. Kartais spontaninė 2 tipo AST remisija įvyksta nepaisant tęsiamo gydymo amiodaronu, tačiau spontaninis pasveikimas nebūdingas 1 tipo AST.
Skubus chirurginis gydymas rekomenduojamas tuomet, kada esant sumažėjusiai kairio skilvelio funkcijai ar sunkiai širdies ir kraujagyslių patologijai reikalinga greita intervencija, o medikamentinis AST gydymas yra nepakankamai veiksmingas. Skubus chirurginis gydymas taikomas esant 1, 2 arba mišriam/neaiškiam AST tipui. Sprendimą atlikti skubią tiroidektomiją turi priimti gydytojų komanda dalyvaujant endokrinologui, kardiologui, anesteziologui ir didelį patyrimą operuojant skydliaukę turinčiam chirurgui.
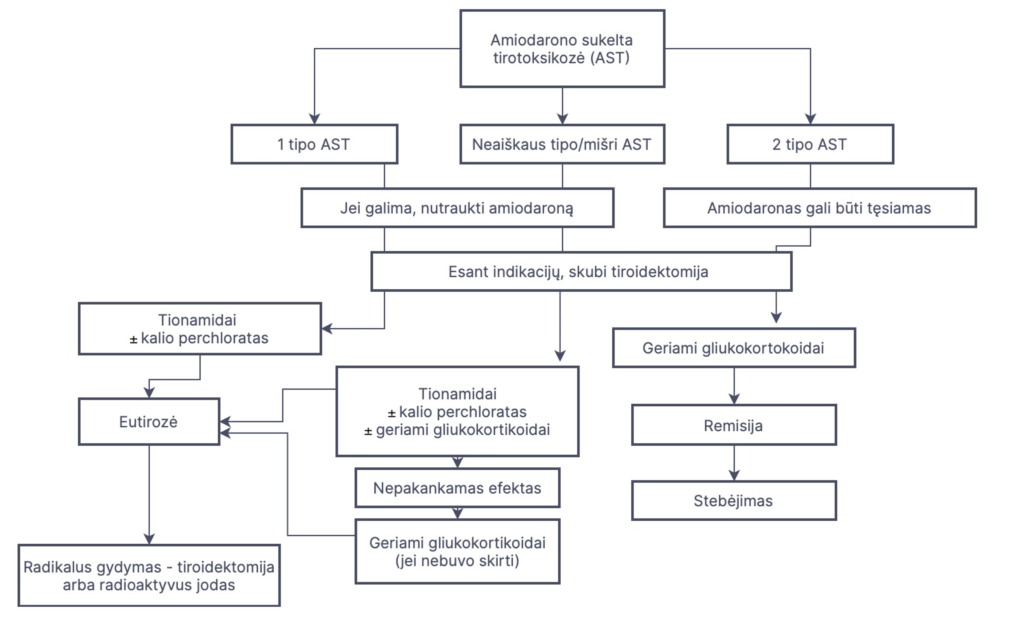
1 tipo AST gydymo principas – skydliaukės hormonų sintezės slopinimas tionamidais (2 paveikslas). Dėl sukaupto didelio hormonų kiekio skydliaukėje reikalingos didesnės nei įprastai tionamidų dozės (metimazolio 40-60 mg/d arba propiltiouracilo 600 – 800 mg/d), o gydymo efektas gali pasireikšti tik 2-4 mėn. po gydymo pradžios. Pasiekus eutirozę, tionamidų dozės mažinamos iki palaikomosios dozės, kuri tęsiama 6-18 mėnesius, kol metabolizuojamas visas perteklinis organizme susikaupęs jodo kiekis. 1 tipo AST gydymui šalia tionamidų galima skirti KClO4 (kalio perchlorato). Šis vaistas blokuoja tironinų sintezę – sutrikdo jodidų „sugavimą“ skydliaukėje, taip sutrikdydamas jodidų oksidaciją ir panaudojimą skydliaukės hormonų sintezėje. Vis dėlto gydymas kalio perchloratu naudojamas retai, nes jis nėra labai veiksmingas, be to, ilgalaikis gydymas toksiškas kraujodaros sistemai – sukelia agranuliocitozę ir aplastinę anemiją. Dėl nepageidaujamų poveikių grėsmės rekomenduojama neviršyti 1 g/dieną kalio perchlorato dozės ir tęsti gydymą ne ilgiau nei 4-6 sav.
Pasiekus medikamentinę eutirozė tionamidais dažniausiai reikalingas ir radikalus toksinės strumos gydymas – totali arba beveik totali tiroidektomija arba radioaktyvaus jodo terapija (2 paveikslas). Tiroidektomija rekomenduojama tiems pacientams, kuriems gydymas amiodaronu yra gyvybiškai reikalingas ir negali būti ilgam atidėtas. Jeigu amiodaroną nutraukti pakankamai saugu, galima svarstyti radioaktyvaus jodo skyrimą, tačiau reikia prisiminti, kad šis gydymo būdas bus veiksmingas tik 6-12 mėn. po amiodarono nutraukimo, išsiskyrus visam pertekliniam jodo kiekiui iš organizmo.
2 tipo AST gydymas – priešuždegiminis. Šiam tipui taikomas gydymas gliukokortikoidais (prednizolonu 30-40 mg per parą 1-3 mėn.). Gliukokortikoidai mažina ląstelių pažeidimą, uždegimines reakcijas bei slopina periferinę T3 gamybą iš T4. Klinikinis ir biocheminis tirotoksikozės pagerėjimas stebimas jau po 1 savaitės nuo gydymo pradžios. Gydymas gliukokortikoidais paprastai tęsiamas iki tol, kol normalizuojasi T4 ir T3 koncentracijos kraujyje.
Esant neaiškiam ar mišriam AST tipui gali būti skiriamas gydymas gliukokortikoidų ir tionamidų deriniu (2 paveiklas). Jei klinikinis tirotoksikozės pagerėjimas pasiekiamas greitai po gydymo pradžios, manoma, kad vyrauja 2 tipo AST, todėl tionamidų dozės gali būti greitai mažinamos ir šis gydymas nutraukiamas. Jei pradinis kombinuotos gliukokortikoidų ir tionamidų terapijos efektas yra nedidelis, galvojama apie 1 tipo AST. Tokiu atveju gliukokortikoidų dozės mažinamos ir gydymas šiais vaistais nutraukiamas, tęsiant ilgalaikį tionamidų skyrimą. Esant neaiškiam arba mišriam AST galima ir kita taktika – pradėti nuo tionamidų skyrimo, o nesant efekto per 4-6 sav. – gydymą papildyti gliukokortikoidais (2 paveikslas).
Literatūros šaltiniai:
1. Bartalena L et al. 2018 European Thyroid Association (ETA) Guidelines for the Management of Amiodarone-Associated Thyroid Dysfunction. Eur Thyroid J 2018;7:55–66
2. Bogazzi F et al. Amiodarone and the thyroid: a 2012 update. J Endocrinol Invest 2012;35:340–348
3. Narayana, S.K., D.R. Woods, and C.J. Boos, Management of amiodarone-related thyroid problems. Therapeutic Advances in Endocrinology and Metabolism, 2011. 2(3): p. 115-126.